Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации) . Очевидно, что все многообразие реакций органических соединений невозможно свести к предложенной классификации (например, реакции горения). Однако такая классификация поможет установить аналогии с уже знакомыми вам реакциями, протекающими между неорганическими веществами.
Как правило, основное органическое соединение, участвующее в реакции, называют субстратом , а другой компонент реакции условно рассматривают как реагент .
Реакции замещения
Реакции замещения - это реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов.
В реакции замещения вступают предельные и ароматические соединения, такие как алканы, циклоалканы или арены. Приведем примеры таких реакций.
Под действием света атомы водорода в молекуле метана способны замещаться на атомы галогена, например, на атомы хлора:
Другим примером замещения водорода на галоген является превращение бензола в бромбензол:

Уравнение этой реакции может быть записано иначе:
![]()
При этой форме записи реагенты, катализатор, условия проведения реакции записывают над стрелкой, а неорганические продукты реакции - под ней.
В результате реакций замещения у органических веществ образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
Реакции присоединения
Реакции присоединения - это реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну.
В реакции присоединения вступают ненасыщенные соединения, такие как алкены или алкины. В зависимости от того, какая молекула выступает в качестве реагента, различают гидрирование (или восстановление), галогенирование, гидрогалогенирование, гидратацию и другие реакции присоединения. Каждая из них требует определенных условий.
1.Гидрирование - реакция присоединения молекулы водорода по кратной связи:
2. Гидрогалогенирование - реакция присоединения галогенводорода (гидрохлорирование):
3. Галогенирование - реакция присоединения галогена:
![]()
4.Полимеризация - особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой - макромолекул.
Реакции полимеризации - это процессы соединения множества молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы) полимера.
Примером реакции полимеризации может служить получение полиэтилена из этилена (этена) под действием ультрафиолетового излучения и радикального инициатора полимеразации R.
Наиболее характерная для органических соединений ковалентная связь образуется при перекрывании атомных орбиталей и образовании общих электронных пар. В результате этого образуется общая для двух атомов орбиталь, на которой находится общая электронная пара. При разрыве связи судьба этих общих электронов может быть разной.
Типы реакционноспособных частиц
Орбиталь с неспаренным электроном, принадлежащая одному атому, может перекрываться с орбиталью другого атома, на которой также находится неспаренный электрон. При этом происходит образование ковалентной связи по обменному механизму:
Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронов, принадлежащих разным атомам.
Процессом, противоположным образованию ковалентной связи по обменному механизму, является разрыв связи, при котором к каждому атому отходит по одному электрону (). В результате этого образуются две незаряженные частицы, имеющие неспаренные электроны:
![]()
Такие частицы называются свободными радикалами.
Свободные радикалы - атомы или группы атомов, имеющие неспаренные электроны.
Свободнорадикальные реакции - это реакции, которые протекают под действием и при участии свободных радикалов.
В курсе неорганической химии это реакции взаимодействия водорода с кислородом, галогенами, реакции горения. Реакции этого типа отличаются высокой скоростью, выделением большого количества тепла.
Ковалентная связь может образоваться и по донорно-акцепторному механизму. Одна из орбиталей атома (или аниона), на которой находится неподеленная электронная пара, перекрывается с незаполненной орбиталью другого атома (или катиона), имеющего незаполненную орбиталь, при этом формируется ковалентная связь, например:
![]()
Разрыв ковалентной связи приводит к образованию положительно и отрицательно заряженных частиц (); так как в данном случае оба электрона из общей электронной пары остаются при одном из атомов, у другого атома получается незаполненная орбиталь:
![]()
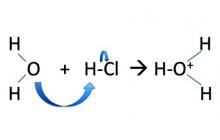
Рассмотрим электролитическую диссоциацию кислот:
![]()
Можно легко догадаться, что частица, имеющая неподеленную электронную пару R: — , т. е. отрицательно заряженный ион, будет притягиваться к положительно заряженным атомам или к атомам, на которых существует по крайней мере частичный или эффективный положительный заряд.
Частицы с неподеленными электронными парами называют нуклеофильными агентами
(nucleus
- «ядро», положительно заряженная часть атома), т. е. «друзьями» ядра, положительного заряда.
Нуклеофилы (Nu ) - анионы или молекулы, имеющие неподеленную пару электронов, взаимодействующие с участками молекул, на которых сосредоточен эффективный положительный заряд.
Примеры нуклеофилов: Сl — (хлорид-ион), ОН — (гидроксид-анион), СН 3 O — (метоксид-анион), СН 3 СОО — (ацетат-анион).
Частицы, имеющие незаполненную орбиталь, напротив, будут стремиться заполнить ее и, следовательно, будут притягиваться к участкам молекул, на которых присутствует повышенная электронная плотность, отрицательный заряд, неподеленная электронная пара. Они являются электрофилами, «друзьями» электрона, отрицательного заряда или частиц с повышенной электронной плотностью.
Электрофилы - катионы или молекулы, имеющие незаполненную электронную орбиталь, стремящиеся к заполнению ее электронами, так как это приводит к более выгодной электронной конфигурации атома.
Электрофилом с незаполненной орбиталью является не любая частица. Так, например, катионы щелочных металлов имеют конфигурацию инертных газов и не стремятся к приобретению электронов, так как имеют низкое сродство к электрону.
Из этого можно сделать вывод, что несмотря на наличие у них незаполненной орбитали, подобные частицы не будут являться электрофилами.
Основные механизмы протекания реакций
Выделено три основных типа реагирующих частиц - свободные радикалы, электрофилы, нуклеофилы - и три соответствующих им типа механизма реакций:
- свободнорадикальные;
- электрофильные;
- нулеофильные.
Кроме классификации реакций по типу реагирующих частиц, в органической химии различают четыре вида реакций по принципу изменения состава молекул: присоединения, замещения, отщепления, или элиминирования (от англ. to eliminate - удалять, отщеплять) и перегруппировки. Так как присоединение и замещение могут происходить под действием всех трех типов реакционноспособных частиц, можно выделить несколько основных механизмов протекания реакций.


Кроме того, рассмотрим реакции отщепления, или элиминирования, которые идут под воздействием нуклеофильных частиц - оснований.
6. Элиминирование:
Отличительной чертой алкенов (непредельных углеводородов) является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
Гидрогалогенирование (присоединение галоген водорода):
При присоединении галогенводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген - к менее гидрированному .

 Классификация реакций По числу исходных и конечных веществ: 1. Присоединение 2. Отщепление (элиминирование) 3. Замещение
Классификация реакций По числу исходных и конечных веществ: 1. Присоединение 2. Отщепление (элиминирование) 3. Замещение
 Классификация реакций По механизму разрыва связей: 1. Гомолитические (радикальные) радикалы 2. Гетеролитические (ионные) ионы
Классификация реакций По механизму разрыва связей: 1. Гомолитические (радикальные) радикалы 2. Гетеролитические (ионные) ионы
 Механизм реакции Механизм – детальное описание химической реакции по стадиям с указанием промежуточных продуктов и частиц. Схема реакции: Механизм реакции:
Механизм реакции Механизм – детальное описание химической реакции по стадиям с указанием промежуточных продуктов и частиц. Схема реакции: Механизм реакции:
 Классификация реакций по типу реагентов 1. Радикальные Радикал –химически активная частица с неспаренным электроном. 2. Электрофильные Электрофил – электронодефицитная частица или молекула с электронодефицитным атомом. 3. Нуклеофильные Нуклеофил – анион или нейтральная молекула, имеющая атом с неподеленной электронной парой.
Классификация реакций по типу реагентов 1. Радикальные Радикал –химически активная частица с неспаренным электроном. 2. Электрофильные Электрофил – электронодефицитная частица или молекула с электронодефицитным атомом. 3. Нуклеофильные Нуклеофил – анион или нейтральная молекула, имеющая атом с неподеленной электронной парой.
 Виды химических связей в органических веществах Основной тип связи – ковалентная (реже встречается ионная) Сигма-связь (σ-): Пи-связь (-)
Виды химических связей в органических веществах Основной тип связи – ковалентная (реже встречается ионная) Сигма-связь (σ-): Пи-связь (-)
 АЛКАНЫ- алифатические (жирные) углеводороды «Алифатос» -масло, жир (греч). Cn. H 2 n+2 Предельные, насыщенные углеводороды
АЛКАНЫ- алифатические (жирные) углеводороды «Алифатос» -масло, жир (греч). Cn. H 2 n+2 Предельные, насыщенные углеводороды
 Гомологический ряд: CH 4 - метан C 2 H 6 - этан C 3 H 8 - пропан C 4 H 10 - бутан C 5 H 12 - пентан т. д. С 6 Н 14 - гексан С 7 Н 16 - гептан С 8 Н 18 - октан С 9 Н 20 - нонан С 10 Н 22 – декан и С 390 Н 782 –ноноконтатриктан (1985 г)
Гомологический ряд: CH 4 - метан C 2 H 6 - этан C 3 H 8 - пропан C 4 H 10 - бутан C 5 H 12 - пентан т. д. С 6 Н 14 - гексан С 7 Н 16 - гептан С 8 Н 18 - октан С 9 Н 20 - нонан С 10 Н 22 – декан и С 390 Н 782 –ноноконтатриктан (1985 г)

 Атомно-орбитальная модель молекулы метана В молекуле метана у атома углерода уже нет S- и Р-орбиталей! Его 4 гибридные, равноценные по энергии и по форме SP 3 -орбитали, образуют 4 -связи с Sорбиталями атома водорода. Н Н 4 -связи
Атомно-орбитальная модель молекулы метана В молекуле метана у атома углерода уже нет S- и Р-орбиталей! Его 4 гибридные, равноценные по энергии и по форме SP 3 -орбитали, образуют 4 -связи с Sорбиталями атома водорода. Н Н 4 -связи

 Реакция нитрования Коновалов Дмитрий Петрович (1856 -1928) 1880 год. Первая удачная попытка оживить «химических мертвецов» , которыми считались алканы. Нашел условия нитрования алканов. Рис. Источник: http: //images. yandex. ru.
Реакция нитрования Коновалов Дмитрий Петрович (1856 -1928) 1880 год. Первая удачная попытка оживить «химических мертвецов» , которыми считались алканы. Нашел условия нитрования алканов. Рис. Источник: http: //images. yandex. ru.
 Химические свойства I. Реакции с разрывом С-Н-связей (реакции замещения): 1. галогенирование 2. нитрование 3. сульфохлорирование II. Реакции с разрывом С-С-связей: 1. горение 2. крекинг 3. изомеризация
Химические свойства I. Реакции с разрывом С-Н-связей (реакции замещения): 1. галогенирование 2. нитрование 3. сульфохлорирование II. Реакции с разрывом С-С-связей: 1. горение 2. крекинг 3. изомеризация


 Как найти химика? Если хочешь найти химика, спроси, что такое моль и неионизованный. И если тот начнет говорить о пушных зверях и организации труда, спокойно уходи. Писатель-фантаст, популяризатор науки Айзек Азимов (1920– 1992) Рис. Источник: http: //images. yandex. ru.
Как найти химика? Если хочешь найти химика, спроси, что такое моль и неионизованный. И если тот начнет говорить о пушных зверях и организации труда, спокойно уходи. Писатель-фантаст, популяризатор науки Айзек Азимов (1920– 1992) Рис. Источник: http: //images. yandex. ru.
 1. Реакция галогенирования Хлорирование: RH + Cl 2 hv RCl + HCl Бромирование: RH + Br 2 hv RBr + HBr Например, хлорирование метана: CH 4 + Cl 2 CH 3 Cl + HCl
1. Реакция галогенирования Хлорирование: RH + Cl 2 hv RCl + HCl Бромирование: RH + Br 2 hv RBr + HBr Например, хлорирование метана: CH 4 + Cl 2 CH 3 Cl + HCl
 Стадии свободно-радикального механизма Схема реакции: CH 4 + Cl 2 CH 3 Cl + HCl Механизм реакции: I. Инициирование цепи – стадия зарождения свободных радикалов. Cl Cl 2 Cl Радикал - активная частица, инициатор реакции. – – Стадия требует энергии в виде нагревания или освещения. Последующие стадии могут протекать в темноте, без нагревания.
Стадии свободно-радикального механизма Схема реакции: CH 4 + Cl 2 CH 3 Cl + HCl Механизм реакции: I. Инициирование цепи – стадия зарождения свободных радикалов. Cl Cl 2 Cl Радикал - активная частица, инициатор реакции. – – Стадия требует энергии в виде нагревания или освещения. Последующие стадии могут протекать в темноте, без нагревания.
 Стадии свободно-радикального механизма II. Рост цепи – основная стадия. CH 4 + Cl HCl + CH 3 + Cl 2 CH 3 Cl + Cl Стадия может включать несколько подстадий, на каждой из которых образуется новый радикал, но не Н !!! На II, основной стадии, обязательно образуется основной продукт!
Стадии свободно-радикального механизма II. Рост цепи – основная стадия. CH 4 + Cl HCl + CH 3 + Cl 2 CH 3 Cl + Cl Стадия может включать несколько подстадий, на каждой из которых образуется новый радикал, но не Н !!! На II, основной стадии, обязательно образуется основной продукт!
 Стадии свободно-радикального механизма III. Обрыв цепи – рекомбинация радикалов. Cl + Cl Cl 2 Cl + CH 3 CH 3 Cl CH 3 + CH 3 CH 3 -CH 3 Два любых радикала соединяются.
Стадии свободно-радикального механизма III. Обрыв цепи – рекомбинация радикалов. Cl + Cl Cl 2 Cl + CH 3 CH 3 Cl CH 3 + CH 3 CH 3 -CH 3 Два любых радикала соединяются.
 Селективность замещения Селективность – избирательность. Региоселективность – избирательность в определенной области реакций. Например, селективность галогенирования: 45% 3% Вывод? 55% 97%
Селективность замещения Селективность – избирательность. Региоселективность – избирательность в определенной области реакций. Например, селективность галогенирования: 45% 3% Вывод? 55% 97%
 Селективность галогенирования зависит от следующих факторов: Условия реакции. При низких температурах идет более селективно. Природа галогена. Чем активнее галоген, тем менее избирательна реакция. F 2 реагирует очень энергично, с разрушением С-С-связей. I 2 не реагирует с алканами в указанных условиях. Строение алкана.
Селективность галогенирования зависит от следующих факторов: Условия реакции. При низких температурах идет более селективно. Природа галогена. Чем активнее галоген, тем менее избирательна реакция. F 2 реагирует очень энергично, с разрушением С-С-связей. I 2 не реагирует с алканами в указанных условиях. Строение алкана.
 Влияние строения алкана на селективность замещения. Если атомы углерода в алкане неравноценны, то замещение при каждом из них идет с разной скоростью. Относительн. скорость реакции замещения Первич. атом Н Вторич. атом Н Трет. атом Н хлорирование 1 3, 9 5, 1 бромирование 1 82 1600 Вывод?
Влияние строения алкана на селективность замещения. Если атомы углерода в алкане неравноценны, то замещение при каждом из них идет с разной скоростью. Относительн. скорость реакции замещения Первич. атом Н Вторич. атом Н Трет. атом Н хлорирование 1 3, 9 5, 1 бромирование 1 82 1600 Вывод?
 Для отрыва третичного атома водорода требуется меньше энергии, чем для отрыва вторичного и первичного! Формула алкана Результат гомолиза ЕД, к. Дж/моль СН 4 СН 3 + Н 435 СН 3 - СН 3 С 2 Н 5 + Н 410 СН 3 СН 2 СН 3 (СН 3)2 СН + Н 395 (СН 3)3 СН (СН 3)3 С + Н 377
Для отрыва третичного атома водорода требуется меньше энергии, чем для отрыва вторичного и первичного! Формула алкана Результат гомолиза ЕД, к. Дж/моль СН 4 СН 3 + Н 435 СН 3 - СН 3 С 2 Н 5 + Н 410 СН 3 СН 2 СН 3 (СН 3)2 СН + Н 395 (СН 3)3 СН (СН 3)3 С + Н 377
 Направление протекания реакций Любая реакция протекает преимущественно в направлении образования более устойчивой промежуточной частицы!
Направление протекания реакций Любая реакция протекает преимущественно в направлении образования более устойчивой промежуточной частицы!
 Промежуточная частица в радикальных реакциях - свободный радикал. Наиболее легко образуется наиболее устойчивый радикал! Ряд устойчивости радикалов: R 3 C > R 2 CH > RCH 2 > CH 3 Алкильные группы проявляют электронодонорный эффект, за счет чего стабилизируют радикал
Промежуточная частица в радикальных реакциях - свободный радикал. Наиболее легко образуется наиболее устойчивый радикал! Ряд устойчивости радикалов: R 3 C > R 2 CH > RCH 2 > CH 3 Алкильные группы проявляют электронодонорный эффект, за счет чего стабилизируют радикал
 Реакция сульфохлорирования Схема реакции: RH + Cl 2 + SO 2 RSO 2 Cl + HCl Механизм реакции: 1. Cl Cl 2 Cl 2. RH + Cl R + HCl R + SO 2 RSO 2 + Cl 2 RSO 2 Cl + Cl и т. д. 3. 2 Cl Cl 2 и т. д.
Реакция сульфохлорирования Схема реакции: RH + Cl 2 + SO 2 RSO 2 Cl + HCl Механизм реакции: 1. Cl Cl 2 Cl 2. RH + Cl R + HCl R + SO 2 RSO 2 + Cl 2 RSO 2 Cl + Cl и т. д. 3. 2 Cl Cl 2 и т. д.
 Реакция Коновалова Д. П. Нитрование по Коновалову проводят действием разбавленной азотной кислоты при температуре 140 о. С. Схема реакции: RH + HNO 3 RNO 2 + H 2 O
Реакция Коновалова Д. П. Нитрование по Коновалову проводят действием разбавленной азотной кислоты при температуре 140 о. С. Схема реакции: RH + HNO 3 RNO 2 + H 2 O
 Механизм реакции Коновалова HNO 3 N 2 O 4 1. N 2 O 4 2 NO 2 2. RH + NO 2 R + HNO 2 R + HNO 3 RNO 2 + OH RH + OH R + H 2 O и т. д. 3. Обрыв цепи.
Механизм реакции Коновалова HNO 3 N 2 O 4 1. N 2 O 4 2 NO 2 2. RH + NO 2 R + HNO 2 R + HNO 3 RNO 2 + OH RH + OH R + H 2 O и т. д. 3. Обрыв цепи.

 Алкены – ненасыщенные углеводороды с одной С=С связью Cn. H 2 n С=С – функциональная группа алкенов
Алкены – ненасыщенные углеводороды с одной С=С связью Cn. H 2 n С=С – функциональная группа алкенов



 Химические свойства алкенов Общая характеристика Алкены – реакционноспособный класс соединений. Они вступают в многочисленные реакции, большинство из которых идут за счет разрыва менее прочной пи-связи. Е С-С (σ-) ~ 350 Кдж/моль Е С=С (-) ~ 260 Кдж/моль
Химические свойства алкенов Общая характеристика Алкены – реакционноспособный класс соединений. Они вступают в многочисленные реакции, большинство из которых идут за счет разрыва менее прочной пи-связи. Е С-С (σ-) ~ 350 Кдж/моль Е С=С (-) ~ 260 Кдж/моль
 Характерные реакции Присоединение – наиболее характерный тип реакций. Двойная связь – донор электронов, поэтому она склонна присоединять: Е – электрофилы, катионы или радикалы
Характерные реакции Присоединение – наиболее характерный тип реакций. Двойная связь – донор электронов, поэтому она склонна присоединять: Е – электрофилы, катионы или радикалы
 Примеры реакций электрофильного присоединения 1. Присоединение галогенов – Присоединяются не все галогены, а только хлор и бром! – Поляризация нейтральной молекулы галогена может происходить под действием полярного растворителя или под действием двойной связи алкена. Красно-коричневый раствор брома становится бесцветным
Примеры реакций электрофильного присоединения 1. Присоединение галогенов – Присоединяются не все галогены, а только хлор и бром! – Поляризация нейтральной молекулы галогена может происходить под действием полярного растворителя или под действием двойной связи алкена. Красно-коричневый раствор брома становится бесцветным
 Электрофильное присоединение Реакции протекают при комнатной температуре, не требуют освещения. Механизм ионный. Схема реакции: XY = Cl 2, Br 2, HCl, HBr, HI, H 2 O
Электрофильное присоединение Реакции протекают при комнатной температуре, не требуют освещения. Механизм ионный. Схема реакции: XY = Cl 2, Br 2, HCl, HBr, HI, H 2 O

 Сигма – комплекс является карбокатионом – частицей с положительным зарядом на атоме углерода. Если в реакционной среде присутствуют другие анионы, то они тоже могут присоединяться к карбокатиону.
Сигма – комплекс является карбокатионом – частицей с положительным зарядом на атоме углерода. Если в реакционной среде присутствуют другие анионы, то они тоже могут присоединяться к карбокатиону.
 Например, присоединение брома, растворенного в воде. Эта качественная реакция на двойную С=С-связь протекает с обесцвечиванием раствора брома и образованием двух продуктов:
Например, присоединение брома, растворенного в воде. Эта качественная реакция на двойную С=С-связь протекает с обесцвечиванием раствора брома и образованием двух продуктов:


 Присоединение к несимметричным алкенам Региоселективность присоединения! Правило Марковникова (1869): кислоты и вода присоединяются к несимметричным алкенам таким образом, что водород присоединяется к более гидрированному атому углерода.
Присоединение к несимметричным алкенам Региоселективность присоединения! Правило Марковникова (1869): кислоты и вода присоединяются к несимметричным алкенам таким образом, что водород присоединяется к более гидрированному атому углерода.
 Марковников Владимир Васильевич (1837 - 1904) Выпускник Казанского университета. С 1869 года – профессор кафедры химии. Основатель научной школы. Рис. Источник: http: //images. yandex. ru.
Марковников Владимир Васильевич (1837 - 1904) Выпускник Казанского университета. С 1869 года – профессор кафедры химии. Основатель научной школы. Рис. Источник: http: //images. yandex. ru.
 Объяснение правила Марковникова Реакция протекает через образование наиболее устойчивой промежуточной частицы – карбокатиона. первичный вторичный, более устойчивый
Объяснение правила Марковникова Реакция протекает через образование наиболее устойчивой промежуточной частицы – карбокатиона. первичный вторичный, более устойчивый
 Ряд устойчивости карбокатионов: третичный вторичный первичный метильный Правило Марковникова в современной формулировке: присоединение протона к алкену происходит с образованием более стабильного карбокатиона.
Ряд устойчивости карбокатионов: третичный вторичный первичный метильный Правило Марковникова в современной формулировке: присоединение протона к алкену происходит с образованием более стабильного карбокатиона.

 Антимарковниковское присоединение CF 3 -CH=CH 2 + HBr CF 3 -CH 2 Br Формально реакция идет против правила Марковникова. CF 3 – электроноакцепторный заместитель Другие электроноакцепторы: NO 2, SO 3 H, COOH, галогены и т. п.
Антимарковниковское присоединение CF 3 -CH=CH 2 + HBr CF 3 -CH 2 Br Формально реакция идет против правила Марковникова. CF 3 – электроноакцепторный заместитель Другие электроноакцепторы: NO 2, SO 3 H, COOH, галогены и т. п.
 Антимарковниковское присоединение более устойчивый неустойчивый CF 3 – электроноакцептор, дестабилизирует карбокатион Реакция только формально идет против правила Марковникова. Фактически ему подчиняется, так как идет через более устойчивый карбокатион.
Антимарковниковское присоединение более устойчивый неустойчивый CF 3 – электроноакцептор, дестабилизирует карбокатион Реакция только формально идет против правила Марковникова. Фактически ему подчиняется, так как идет через более устойчивый карбокатион.
 Перекисный эффект Хараша X CH 3 -CH=CH 2 + HBr CH 3 -CH 2 Br X = O 2, H 2 O 2, ROOR Механизм свободнорадикальный: 1. H 2 O 2 2 OH + HBr H 2 O + Br 2. CH 3 -CH=CH 2 + Br CH 3 -CH -CH 2 Br более устойчивый радикал CH 3 -CH -CH 2 Br + HBr CH 3 -CH 2 Br + Br и т. д. 3. Два любых радикала соединяются между собой.
Перекисный эффект Хараша X CH 3 -CH=CH 2 + HBr CH 3 -CH 2 Br X = O 2, H 2 O 2, ROOR Механизм свободнорадикальный: 1. H 2 O 2 2 OH + HBr H 2 O + Br 2. CH 3 -CH=CH 2 + Br CH 3 -CH -CH 2 Br более устойчивый радикал CH 3 -CH -CH 2 Br + HBr CH 3 -CH 2 Br + Br и т. д. 3. Два любых радикала соединяются между собой.
 Электрофильное присоединение 3. Гидратация – присоединение воды – Реакция протекает в присутствии кислотных катализаторов, чаще всего это – серная кислота. – Реакция подчиняется правилу Марковникова. Дешевый способ получения спиртов
Электрофильное присоединение 3. Гидратация – присоединение воды – Реакция протекает в присутствии кислотных катализаторов, чаще всего это – серная кислота. – Реакция подчиняется правилу Марковникова. Дешевый способ получения спиртов
 На экзамене академик Иван Алексеевич Каблуков просит студента рассказать, как в лаборатории получают водород. «Из ртути» , - отвечает тот. «Как это "из ртути"? ! Обычно говорят "из цинка", а вот из ртути - это что-то оригинальное. Напишите-ка реакцию» . Студент пишет: Hg = Н + g И говорит: «Ртуть нагревают; она разлагается на Н и g. Н - водород, он легкий и поэтому улетает, а g - ускорение силы тяжести, тяжелое, остается» . «За такой ответ надо ставить "пятерку", - говорит Каблуков. - Давайте зачетку. Только "пятерку" я сначала тоже подогрею. "Три" улетает, а "два" остается» .
На экзамене академик Иван Алексеевич Каблуков просит студента рассказать, как в лаборатории получают водород. «Из ртути» , - отвечает тот. «Как это "из ртути"? ! Обычно говорят "из цинка", а вот из ртути - это что-то оригинальное. Напишите-ка реакцию» . Студент пишет: Hg = Н + g И говорит: «Ртуть нагревают; она разлагается на Н и g. Н - водород, он легкий и поэтому улетает, а g - ускорение силы тяжести, тяжелое, остается» . «За такой ответ надо ставить "пятерку", - говорит Каблуков. - Давайте зачетку. Только "пятерку" я сначала тоже подогрею. "Три" улетает, а "два" остается» .

 Двое химиков в лаборатории: - Вась, опусти руку в этот стакан. - Опустил. - Что-нибудь чувствуешь? - Нет. - Значит серная кислота в другом стакане.
Двое химиков в лаборатории: - Вась, опусти руку в этот стакан. - Опустил. - Что-нибудь чувствуешь? - Нет. - Значит серная кислота в другом стакане.
 Ароматические углеводороды Ароматический – душистый? ? Ароматические соединения – это бензол и вещества, напоминающие его по химическому поведению!
Ароматические углеводороды Ароматический – душистый? ? Ароматические соединения – это бензол и вещества, напоминающие его по химическому поведению!
Классификация реакций
Существуют четыре основные типа реакций, в которых участвуют органические соединения: замещение (вытеснение), присоединение, элиминирование (отщепления), перегруппировки.
3.1 Реакции замещения
В реакциях первого типа замещение обычно происходит у атома углерода, но замещенный атом может быть атомом водорода или каким-либо другим атомом или группой атомов. При электрофильном замещении чаще всего замещается атом водорода; примером служит классическое ароматическое замещение:
При нуклеофильном замещении чаще замещается не атом водорода, а другие атомы, например:
NC - + R−Br → NC−R +BR -
3.2 Реакции присоединения
Реакции присоединения также могут быть электрофильными, нуклеофильными или радикальными в зависимости от типа частиц, инициирующих процесс. Присоединение к обычным двойным углерод-углеродным связям индуцируется, как правило, электрофилом или радикалом. Например, присоединение HBr
может начинаться с атаки двойной связи протоном Н + или радикалом Br·.
3.3 Реакции элиминирования
Реакции элиминирования по существу обратны реакциям присоединения; наиболее обычный тип такой реакции – отщепление атома водорода и другого атома или группы от соседних атомов углерода с образованием алкенов:
3.4 Реакции перегруппировки
Перегруппировки также могут протекать через промежуточные соединения, представляющие собой катионы, анионы или радикалы; чаще всего эти реакции идут с образованием карбокатионов или других электронодефицитных частиц. Перегруппировки могут включать существенную перестройку углеродного скелета. За стадией собственно перегруппировки в таких реакциях часто следуют стадии замещения, присоединения или отщепления, приводящие к образованию стабильного конечного продукта.
Детальное описание химической реакции по стадиям называется механизмом. С электронной точки зрения под механизмом химической реакции понимают способ разрыва ковалентных связей в молекулах и последовательность состояний, через которые проходят реагирующие вещества до превращения в продукты реакций.
4.1 Свободно-радикальные реакции
Свободно-радикальные реакции – это химические процессы, в которых принимают участие молекулы, имеющие неспаренные электроны. Определенные аспекты реакций свободных радикалов являются уникальными в сравнении с другими типами реакций. Основное различие состоит в том, что многие свободно-радикальные реакции являются цепными. Это означает существование механизма, благодаря которому множество молекул превращается в продукт с помощью повторяющегося процесса, инициируемого созданием одной реакционноспособной частицы. Типичный пример иллюстрируется с помощью следующего гипотетического механизма:
Стадию, на которой генерируется реакционный интермедиат, в данном случае А·, называется инициированием. Эта стадия протекает при высокой температуре, под действием УФ или пероксидов, в неполярных растворителях. В следующих четырех уравнениях данного примера повторяется последовательность двух реакций; они представляют фазу развития цепи. Цепные реакции характеризуются длиной цепи, которая соответствует числу стадий развития, приходящихся на одну стадию инициирования. Вторая стадия протекает одновременным синтезом соединения и образования нового радикала, который продолжает цепь превращений. Последней стадией является стадией обрыва цепи, которая включает любую реакцию, в которой разрушается один из реакционных интермедиатов, необходимых для развития цепи. Чем больше стадий обрыва цепи, тем меньшей становится длина цепи.
Свободно-радикальные реакции протекают: 1)на свету, при высокой температуре или в присутствии радикалов, которые образуются при разложении других веществ; 2)тормозятся веществами, легко реагирующими со свободными радикалами; 3)протекают в неполярных растворителях или в паровой фазе; 4)часто имеют автокаталитический и индукционный период перед началом реакции; 5)в кинетическом отношении являются цепными.
Реакции радикального замещения характерны для алканов, а радикального присоединения – для алкенов и алкинов.
СН 4 + Сl 2 → CH 3 Cl + HCl
CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 Br
CH 3 -C≡CH + HCl → CH 3 -CH=CHCl
Соединение свободных радикалов между собой и обрыв цепи происходит в основном на стенках реактора.
4.2 Ионные реакции
Реакции, в которых происходит гетеролитический разрыв связей и образуются промежуточные частицы ионного типа, называются ионными реакциями.
Ионные реакции протекают: 1)в присутствии катализаторов (кислот или оснований и не подвержены влиянию света или свободных радикалов, в частности, возникающих при разложении пероксидов); 2)не подвергаются влиянию акцепторов свободных радикалов; 3)на ход реакции оказывает влияние природа растворителя; 4)редко протекают в паровой фазе; 5)кинетически являются, в основном, реакциями первого или второго порядка.
По характеру реагента, действующего на молекулу, ионные реакции делятся на электрофильные и нуклеофильные . Реакции нуклеофильного замещения характерны для алкил- и арилгалогенидов,
CH 3 Cl + H 2 O → CH 3 OH + HCl
C 6 H 5 -Cl + H 2 O → C 6 H 5 -OH + HCl
C 2 H 5 OH + HCl → C 2 H 5 Cl + H 2 O
C 2 H 5 NH 2 + CH 3 Cl → CH 3 -NH-C 2 H 5 + HCl
электрофильного замещения – для алканов в присутствии катализаторов
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH(CH 3)-CH 2 -CH 3
и аренов.
C 6 H 6 + HNO 3 + H 2 SO 4 → C 6 H 5 -NO 2 + H 2 O
Реакции электрофильного присоединения характерны для алкенов
CH 3 -CH=CH 2 + Br 2 → CH 3 -CHBr-CH 2 Br
и алкинов,
CH≡CH + Cl 2 → CHCl=CHCl
нуклеофильного присоединения – для алкинов.
CH 3 -C≡CH + C 2 H 5 OH + NaOH → CH 3 -C(OC 2 H 5)=CH 2
Методические указания для самостоятельной работы студентов 1-го курса по биологической и биоорганической химии
(модуль 1)
Утверждено
Учёным советом университета
Харьков ХНМУ
Основные типы и механизмы реакций в органической химии: Метод. указ. для студентов 1-го курса / сост. А.О. Сыровая, Л.Г. Шаповал, В.Н. Петюнина, Е.Р. Грабовецкая, В.А. Макаров, С.В. Андреева, С.А. Наконечная, Л.В. Лукьянова, Р.О. Бачинский, С.Н. Козуб, Т.С. Тишакова, О.Л. Левашова, Н.В. Копотева, Н.Н. Чаленко. – Харьков: ХНМУ, 2014. – С. 32.
Составители: А.О. Сыровая, Л.Г. Шаповал, В.Н. Петюнина, Е.Р. Грабовецкая, В.А. Макаров, С.В. Андреева, Л.В. Лукьянова, С.А. Наконечная, Р.О. Бачинский, С.Н. Козуб, Т.С. Тишакова, О.Л. Левашова, Н.В. Копотева, Н.Н. Чаленко
Тема I: классификация химических реакций.
РЕАКЦИОННАЯ СПОСОБНОСТЬ АЛКАНОВ, АЛКЕНОВ, АРЕНОВ, СПИРТОВ, ФЕНОЛОВ, АМИНОВ, АЛЬДЕГИДОВ, КЕТОНОВ И КАРБОНОВЫХ КИСЛОТ
Мотивационная характеристика темы
Изучение данной темы является основой для понимания некоторых биохимических реакций, которые имеют место в процессе обмена веществ в организме (пероксидное окисление липидов, образование гидроксикислот из ненасыщенных в цикле Кребса и др.), а также для понимания механизма подобных реакций при синтезе врачебных препаратов и аналогов естественных соединений.
Учебная цель
Уметь прогнозировать способность основных классов органических соединений вступать в реакции гомолитического и гетеролитического взаимодействия согласно их электронному строению и электронным эффектам заместителей.
1. СВОБОДНО-РАДИКАЛЬНЫЕ И ЕЛЕКТРОФИЛЬНЫЕ РЕАКЦИИ (РЕАКЦИОННАЯ СПОСОБНОСТЬ УГЛЕВОДОРОДОВ)
Учебно-целевые вопросы
1. Уметь описать механизмы следующих реакций:
Радикального замещения - R S
Электрофильного присоединения - A E
Электрофильного замещения - S E
2. Уметь объяснить влияние заместителей на реакционную способность при електрофильних взаимодействиях исходя из электронных эффектов.
Исходный уровень
1. Строение атома углерода. Типы гибридизации его электронных орбиталей.
2. Строение, длина и энергия - и - связей.
3. Конформации циклогексана.
4. Сопряжение. Открытые и закрытые (ароматические) сопряженные системы.
5. Электронные эффекты заместителей.
6. Переходное состояние. Электронное строение карбкатиона. Интермедиаторы - и - комплексы.
Практические нав ы ки
1. Научиться определять возможность разрыва ковалентной связи, тип и механизм реакции.
2. Уметь экспериментально выполнять реакции бромирования соединений с двойными связями и ароматических соединений.
Контрольные вопросы
1. Приведите механизм реакции гидрирования этилена.
2. Опишите механизм реакции гидратации пропеновой кислоты. Объясните роль кислотного катализа.
3. Напишите уравнение реакции нитрирования толуола (метилбензола). По какому механизму протекает эта реакция?
4. Объясните дезактивирующее и ориентирующее влияние нитрогруппы в молекуле нитробензола на примере реакции бромирования.
Учебные задачи и алгоритмы их решения
Задача №1. Опишите механизм реакции бромирования изобутана и циклопентана при облучении светом.
Алгоритм решения . Молекулы изобутана и циклопентана состоят из sp 3 гибридизованих атомов углерода. С - С связи в их молекулах неполярные, а связи С – Н малополярные. Эти связи достаточно легко подвергаются гомолитичному разрыву с образованием свободных радикалов - частичек, которые имеют неспаренные электроны. Таким образом, в молекулах этих веществ должна протекать реакция радикального замещения - R S -реакция или цепная.
Стадиями любой R S -реакции есть: инициирование, рост и обрыв цепи.
Инициирование - это процесс образования свободных радикалов при высокой температуре или облучении ультрафиолетом:
Рост цепи происходит за счет взаимодействия высокореакционноспособного свободного радикала Br с малополярной С - Н связью в молекуле циклопентана с образованием нового циклопентил-радикала:

Циклопентил-радикал взаимодействует с новой молекулой брома, вызывая в ней гомолитический разрыв связи и образуя бромоциклопентан и новый радикал брома:

Свободный радикал брома атакует новую молекулу циклопентана. Таким образом, стадия роста цепи повторяется многократно, т.е., происходит цепная реакция. Обрыв цепи завершает цепную реакцию за счет соединения разных радикалов:

Поскольку все углеродные атомы в молекуле циклопентана равноценные, образуется только моноциклобромпентан.
В изобутане С - Н связи не являются равноценными. Они отличаются энергией гомолитической диссоциации и стабильностью образованных свободных радикалов. Известно, что энергия разрыва С - Н связи увеличивается от третичного до первичного углеродного атома. Стабильность же свободных радикалов в таком же порядке уменьшается. Именно поэтому в молекуле изобутана реакция бромирования протекает региоселективно - по третичному атому углерода:

Надо указать, что для более активного радикала хлора региоселективность не придерживается в полной мере. При хлорировании замещению могут подлежать атомы водорода при любых атомах углерода, но содержимое продукта замещения при третичном углероде будет наибольшим.
Задача №2. На примере олеиновой кислоты опишите механизм реакции пероксидного окисления липидов, которые имеет место при лучевой болезни в результате повреждения клеточных мембран. Какие вещества выполняют роль антиоксидантов в нашем организме?
Алгоритм решения. Примером радикальной реакции есть пероксидное окисления липидов, при котором действия радикалов подвергаются ненасыщенные жирные кислоты, которые входят в состав клеточных мембран. При радиоактивном облучении возможный распад на радикалы молекул воды. Гидроксильные радикалы атакуют молекулу ненасыщенной кислоты по метиленовой группе, соседней с двойной связью. При этом образуется радикал, стабилизированный за счет участия неспаренного электрона в сопряжении с электронами -связей. Далее органический радикал взаимодействует с бирадикальной молекулой кислорода с образованием нестабильных гидропероксидов, которые распадаются с образованием альдегидов, которые окисляются до кислот - конечные продукты реакции. Следствием пероксидного окиснення является разрушение клеточных мембран:

Ингибирующее действие витамина Е (токоферола) в организме обусловлено его способностью связывать свободные радикалы, которые образуются в клетках:

В феноксидном радикале, который образовался, неспаренный электрон находится в сопряжении с -электронным облаком ароматического кольца, которое приводит к его относительной стабильности.
Задача №3. Приведите механизм реакции бромирования этилена.
Алгоритм решения. Для соединений, которые состоят из атомов углерода в состоянии sp 2 - или sp-гибридизации, типичными есть реакции, которые проходят с разрывом -связей, т.е., реакции присоединения. Эти реакции могут протекать по радикальному или ионному механизму в зависимости от природы реагента, полярности растворителя, температуры, и т.п.. Ионные реакции протекают под действием или электрофильных реагентов, которые имеют сродство к электрону, или нуклеофильных, которые отдают свои электроны. Электрофильными реагентами могут быть катионы и соединения, которые имеют атомы с незаполненными электронными оболочками. Простейший электрофильный реагент - протон. Нуклеофильные реагенты - это анионы, или соединения с атомами, которые имеют неразделенные электронные пары.
Для алкенов - соединений, которые имеют sp 2 - или sp-гибридизованный атом углерода, типичными есть реакции электрофильного присоединения - А Е реакции. В полярных растворителях в отсутствии солнечного света реакция галогенирования протекает по ионному механизму с образованием карбкатионов:

Под действием π-связи в этилене молекула брома поляризуется с образованием неустойчивого π-комплекса, который превращается в карбкатион. В нем бром связан с углеродом π-связью. Процесс завершается взаимодействием аниона брома с этим карбкатионом к конечному продукту реакции – дибромоэтана.
Задача №4 . На примере реакции гидратации пропена обоснуйте правило Марковникова.
Алгоритм решения. Поскольку молекула воды - нуклеофильный реагент, то ее присоединение по двойной связи без катализатора невозможно. Роль катализаторов в таких реакциях выполняют кислоты. Образование карбкатионов происходит при присоединении протона кислоты при разрыве π-связи:

К карбкатиону, который образовался, присоединяется молекула воды за счет спаренных электронов атома кислорода. Образуется стойкое алкильное производное оксония, которое стабилизируется с выделением протона. Продукт реакции вторпропанол (пропан-2-ол).
В реакции гидратации протон присоединяется согласно правилу Марковникова - к более гидрогенизированному атому углерода, поскольку, вследствие положительного индуктивного эффекта СН 3 группы именно к этому атому смещена электронная плотность. Кроме того, образованный вследствие присоединения протона третичный карбкатион более стабильный, чем первичный (влияние двух алкильных групп).
Задача № 5. Обоснуйте возможность образования 1,3-дибромопропана при бромировании циклопропана.
Алгоритм решения. Молекулы, которые представляют собой трех или четырехчленные циклы (циклопропан и циклобутан) проявляют свойства ненасыщенных соединений, поскольку электронное состояние их "банановых" связей напоминает π-связь. Поэтому подобно ненасыщенным соединениям они вступают в реакции присоединения с разрывом цикла:

Задача № 6. Опишите реакцию взаимодействия бромоводорода с бутадиеном-1,3. В чем особенность этой реакции?
Алгоритм решения. При взаимодействии бромоводорода с бутадиеном-1,3 образуются продукты 1,2 присоединение (1) и 1,4 присоединение (2):

Образование продукта (2) обусловлено наличием в сопряженной системе общей для всей молекулы π-электронного облака, вследствие чего она вступает в реакцию электрофильного присоединения (А Е - реакцию) в виде целого блока:

Задача № 7. Опишите механизм реакции бромирования бензола.
Алгоритм решения. Для ароматических соединений, которые содержат замкнутую сопряженно - электронную систему и которые имеют вследствие этого значительную прочность, характерны реакции электрофильного замещения. Наличие повышенной электронной плотности по обе стороны кольца защищают его от атаки нуклеофильными реагентами и наоборот - облегчают возможность атаки катионами и другими электрофильными реагентами.
Взаимодействие бензола с галогенами происходит в присутствии катализаторов - AlCl 3 , FeCl 3 (так называемых кислот Льюиса). Они вызывают поляризацию молекулы галогена, после чего она атакует π-электроны бензольного кольца:

π-комплекс σ-комплекс
В начале образуется π- комплекс, который медленно переходит в σ - комплекс, в котором бром образует ковалентную связь с одним из атомов углерода за счет двух из шести электронов ароматического кольца. Четыре π-электроны, которые остались, равномерно распределенные между пятью атомами углеродного кольца; σ-комплекс является менее выгодной структурой вследствие нарушения ароматичности, которая восстанавливается путем выброса протона.
К реакциям электрофильного замещения в ароматических соединениях относятся также сульфирование и нитрирование. Роль нитрирующего агента выполняет нитроил-катион - NO 2+ , который образуется при взаимодействии концентрированной серной и азотной кислот (нитрирующая смесь); а роль сульфирующего агента - катион SO 3 H + , или оксид серы (ІV), если сульфирование ведут олеумом.
Алгоритм решения. Активность соединений в S E -реакциях зависит от величины электронной плотности в ароматическом ядре (зависимость прямая). В связи с этим реакционная способность веществ должна рассматриваться во взаимосвязи с электронными эффектами заместителей и гетероатомов.

Аминогруппа в анилине проявляет +М эффект, вследствие чего в бензольном ядре электронная плотность увеличивается и наибольшая ее концентрация наблюдается в орто- и пара-положениях. Протекание реакции облегчается.
Нитрогруппа в нитробензоле имеет -І и -М эффекты, поэтому дезактивирует бензольное кольцо и именно в орто- и парах-положениях. Поскольку взаимодействие электрофила происходит в месте высочайшей электронной плотности, то в этом случае образуются мета-изомеры. Таким образом, электродонорные заместители - это орто- и пара-ориентанты (ориентанты І рода и активаторы S E -реакций; электроноакцепторные заместители - мета-ориентанты (ориентанты ІІ рода) дезактиваторы S E -реакций).
В пятичленных гетероциклах (пиррол, фуран, тиофен), которые относятся к π-избыточным системам, S E -реакции протекают легче, чем в бензоле; при этом более реакционноспособным является α-положение.
Гетероциклические системы с пиридиновым атомом азота являются π -недостаточными, поэтому тяжелее вступают в реакции электрофильного замещения; при этом электрофил занимает β-положение по отношению к атому азота.
CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
Реакции присоединеия
Такие реакции характерны для органических соединений, содержащих кратные(двойные или тройные) связи. К реакциям этого типа относятся реакции присоединения галогенов, галогеноводородов и воды к алкенам и алкинам
CH 3 -CH=CH 2 + HCl ---- CH 3 -CH(Cl)-CH 3
Реакции отщепления (элиминирования)
Это реакции, приводящие к образованию кратных связей. При отщеплении галогеноводородов и воды наблюдается определенная селективность реакции, описываемая правилом Зайцева, согласно которому атом водорода отщепляется от того атома углерода, при котором находится меньше атомов водорода. Пример реакции
CH3-CH(Cl)-CH 2 -CH 3 + KOH →CH 3 -CH=CH-CH 3 + HCl
Полимеризации и поликонденсации
n(CH 2 =CHCl) (-CH 2 -CHCl)n
Окислительно-восстановительные
Наиболее интенсивная из окислительных реакций – это горение, реакция, характерная для всех классов органических соединений. При этом в зависимости от условий горения углерод окисляется до С (сажа), СО или СО 2 , а водород превращается в воду. Однако для химиков-органиков большой интерес представляют реакции окисления, проводимые в гораздо более мягких условиях, чем горение. Используемые окислители: растворы Br2 в воде или Cl2 в CCl 4 ; KMnO 4 в воде или разбавленной кислоте; оксид меди; свежеосажденные гидроксиды серебра (I) или меди(II).
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Этерификации (и обратной ей реакции гидролиза)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Циклоприсоединение
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. Классификация органических реакций по механизму. Примеры.
Механизм реакции предполагает детальное постадийное описание химических реакций. При этом устанавливают, какие именно ковалентные связи разрываются, в каком порядке и каким путем. Столь же тщательно описывают образование новых связей в процессе реакции. Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический.
Радикальные реакции протекают путем гомолитического (радикального) разрыва ковалентной связи:

Радикальному разрыву подвергаются неполярные или малополярные ковалентные связи (С–С, N–N, С–Н) при высокой температуре или под действием света. Углерод в радикале СН 3 имеет 7 внешних электронов (вместо устойчивой октетной оболочки в СН 4). Радикалы неустойчивы, они стремятся захватить недостающий электрон (до пары или до октета). Один из способов образования устойчивых продуктов – димеризация (соединение двух радикалов):
СН 3 + СН 3 СН 3 : СН 3 ,
Н + Н Н : Н.
Радикальные реакции – это, например, реакции хлорирования, бромирования и нитрования алканов:

Ионные реакции протекают с гетеролитическим разрывом связи. При этом промежуточно образуются короткоживущие органические ионы – карбкатионы и карбанионы – с зарядом на атоме углерода. В ионных реакциях связывающая электронная пара не разъединяется, а целиком переходит к одному из атомов, превращая его в анион:

К гетеролитическому разрыву склонны сильно полярные (Н–O, С–О) и легко поляризуемые (С–Вr, С–I) связи.
Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны). Утверждение, что та или иная реакция является нуклеофильной или электрофильной, условно всегда относится к реагенту. Реагент – участвующее в реакции вещество с более простой структурой. Субстрат – исходное вещество с более сложной структурой. Уходящая группа – это замещаемый ион, который был связан с углеродом. Продукт реакции – новое углеродсодержащее вещество (записывается в правой части уравнения реакции).
К нуклеофильным реагентам (нуклеофилам) относят отрицательно заряженные ионы, соединения с неподеленными парами электронов, соединения с двойными углерод-углеродными связями. К электрофильным реагентам (электрофилам) относят положительно заряженные ионы, соединения с незаполненными электронными оболочками (АlCl 3 , ВF 3 , FeCl 3), cоединения с карбонильными группами, галогены. Электрофилы – любые атом, молекула или ион, способные присоединить пару электронов в процессе образования новой связи. Движущая сила ионных реакций – взаимодействие противоположно заряженных ионов или фрагментов разных молекул с частичным зарядом (+ и –).